Golongan ditempatkan pada lajur vertikal dalam tabel. Penentuan golongan berdasarkan sifat-sifat yang dimiliki unsur tersebut, yaitu memiliki sifat-sifat yang mirip.
Beberapa golongan diberi nama khusus, yaitu:
- Golongan IA, disebut golongan alkali (kecuali H), terdiri dari H, Li, Na, K, Rb, Cs, Fr;
- Golongan IIA, disebut golongan alkali tanah, terdiri dari Be, Mg, Ca, Sr, Ba, Ra;
- Golongan VIIA, disebut golongan halogen, terdiri dari F, Cl, Br, I, At;
- Golongan VIIIA, disebut golongan gas mulia, terdiri dari He, Ne, Ar, Kr, Xe, Rn;
- Golongan IIIA, disebut golongan boron-aluminium, terdiri dari B, Al, Ga, In, Ti;
- Golongan IVA, disebut golongan karbon-silikon, terdiri dari C, Si, Ge, Sn, Pb;
- Golongan VA, disebut golongan nitrogen-fosforus, terdiri dari N, P, As, Sb, Bi;
- Golongan VIA, disebut golongan oksigen-belerang, terdiri dari O, S, Se, Te, Po;
- Golongan IB sampai dengan VIIIB disebut golongan transisi
Periode
Periode ditempatkan pada lajur horizontal dalam tabel. Periode suatu unsur menunjukkan nomor kulit yang sudah terisi elektron berdasarkan konfigurasi elektron, yaitu:
- Periode ke-1, terdiri atas 2 unsur
- Periode ke-2, terdiri atas 8 unsur
- Periode ke-3, terdiri atas 8 unsur
- Periode ke-4, terdiri atas 18 unsur
- Periode ke-5, terdiri atas 18 unsur
- Periode ke-6, terdiri atas 32 unsur, 18 unsur seperti period eke-4 dan ke-5, 14 unsur deret lantanida
- Periode ke-7, merupakan periode unsur yang belum lengkap. Terdapat deret aktinida.
Itulah penjelasan mengenai unsur kimia dan tabel periodik unsur kimia. Untuk mengetahui jenis-jenis perubahan kimia, bisa disimak di artikel ini. Semoga bermanfaat ya!
Artikel disadur dari berbagai sumber















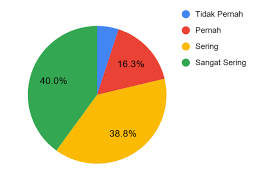










Leave a Reply